VetBact
Veterinärmedicinsk bakteriologi: information om betydelsefulla arter
Veterinärmedicinsk bakteriologi
| Innehåll |
|---|
| Diffusionsmetoden |
| Dilutionsmetoden |
| Enzymer |
| Genotypiska metoder |
| Kvalitetskontroll |
Före behandling av en bakteriell infektion görs ofta en resistensbestämning där den isolerade bakteriens känslighet mot olika antibiotika undersöks in vitro för att ge en vägledning vid val av behandling. Det slutliga behandlingsresultatet beror på olika faktorer t ex vilket organ som drabbats, typ av infektion, djurslag, immunstatus, hur lång tid djuret haft infektionen etc. För att resultaten av resistensundersökningarna ska vara jämförbara måste testerna vara standardiserade. De metoder som används vid fenotypisk resistensundersökning är av tre principiellt olika typer.
Uppdaterad: 2024-03-17.
InnehållEn bakteriesuspension med en turbiditet på 0,5 sprids jämnt över en Mueller-Hinton agar, Därefter fördelas antibiotika lappparna med kända koncentrationer.på agarn. Plattan inkuberas och därefter mäts hämningszonerna enligt standardiserade metoder - Klicka på bilden för att förstora den.
Bild: Theodoros Ntallaris (KV, SLU), Tobi Olaoye (KV, SLU) och Ingrid Hansson (HBIO, SLU).
Diskdiffusionsmetoden är en av de äldsta och mest använda metoderna vid resistensundersökning. Mueller-Hinton agar är den vanligaste mediet som används vid resistensundersökning genom diskdiffusionsmetoden, för svagt växande bakterier används modifierad Mueller-Hintonagar med tillsats av blod och β-NAD.
På agarplattan inokulerad med den bakteriestam som ska resistensundersökas läggs diskar (filtrerlappar) impregnerade med bestämda koncentrationer av antibiotika. Koncentrationerna av antibiotika i diskarna har valts för att ge zonstorlekar som korrelerar med de serumnivåer som kan nås hos patienten.
Därefter inkuberas plattan i aerob atmosfär med undantag av vissa kräsna bakterier såsom Haemophilus spp. vilka inkuberas i ökad CO2 halt (5%). De olika antimikrobiella substanserna diffunderar radiellt ut i mediet från antibiotikadisken och späds därigenom ut - ju längre från disken desto lägre koncentration. Samtidigt börjar bakterierna efter en kort lag-fas att dela sig. Beroende på bakteriens delningshastighet, dess känslighet för aktuell substans och substansens diffusionshastighet kommer hämningszoner av olika storlek att kunna avläsas runt lapparna. Zonens diameter är indirekt proportionell till stammens MIC-värde och med hjälp av brytpunktstabeller kan man avgöra om bakterien är känslig (S), intemediär (I) eller resistent (R).
Uppdaterad: 2024-08-23.
Innehåll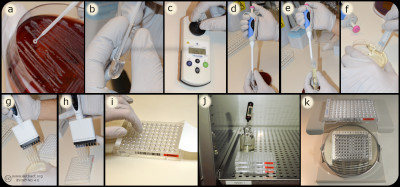 Bakterier (a) blandas med ultra rent vatten/NaCl lösning (b) till en turbiditet på 0,5 McFarland (c). En liten del av bakteriesuspensionen (d) blandas (e) med Mueller-Hinton buljong (f) som inokuleras (g) i brunnarna i microtiterplattan (h). Därefter täcks plattan med plastfilm (i) och inkuberas (j) innan avläsning av MIC-värde (k). Bild: Homayoon Davam, Alva Gustafsson, Ingrid Hanssson (HBIO, SLU). - Klicka på bilden för att förstora den.
Bakterier (a) blandas med ultra rent vatten/NaCl lösning (b) till en turbiditet på 0,5 McFarland (c). En liten del av bakteriesuspensionen (d) blandas (e) med Mueller-Hinton buljong (f) som inokuleras (g) i brunnarna i microtiterplattan (h). Därefter täcks plattan med plastfilm (i) och inkuberas (j) innan avläsning av MIC-värde (k). Bild: Homayoon Davam, Alva Gustafsson, Ingrid Hanssson (HBIO, SLU). - Klicka på bilden för att förstora den.
Vid dilutionsmetoden bestäms minsta hämmande koncentrationen (Minimum Inhibitory Concentration, MIC) av antibiotika. Metoden innebär att bakterien odlas på agar eller buljong med olika koncentrationer av antibiotika. Av praktiska skäl används vid rutindiagnostik numera främst kommersiellt tillgängliga microtiterplattor där spädningsserier av olika antibiotika förberetts och ofta dunstats in. Två av brunnarna är dock oftast antibiotikafria och används som tillväxtkontroll.
Bakterier vars resistens ska undersökas tas från en renkultur och blandas med ultra rent vatten eller NaCl-lösning för att få en bestämd koncentration av bakterier, vilket i regel innebär en turbiditet på 0,5 McFarland (se figur). Därefter blandas suspensionen med Mueller-Hinton buljong så att en önskad koncentration erhålls, och för svagt växande bakterier tillsätts ofta 5% serum för att få önskad tillväxt. Efter inokuleringen av bestämd volym bakteriesuspensionen i varje brunn förseglas microtiterplattan med en plastfilm och inkuberas vid den undersökta bakteriens optimala odlingsförhållande, såsom tid, temperatur och atmosfär.
Efter inkubering avläses först tillväxtkontrollen för att kontrollera att bakterien växt i de brunnar som inte innehåller antibiotika. Därefter avläses växt eller inte växt i de olika brunnarna med antibiotika. I den brunn med den lägsta koncentration av antibiotika där ingen växt ses vid närvaro av respektive antibiotika anges som MIC uttryckt i mg/L eller μg/ml. För att bestämma känsligheten för bakterien jämförs det erhållna MIC värdet med brytpunkter (epidemiological cut-off values, ECOFF) för aktuella antibiotika i någon av de vetenskapliga kommittéernas framtagna riktlinjer för antimikrobiell resistens såsom European Committee on Antimicrobial Susceptibility Testing (EUCAST, https://www.eucast.org/mic_distributions_and_ecoffs).
En annan dilutionsmetod är Epsilometer test (E-test) MIC bestäms genom att använda gradientremsor, vilka är impregnerade med kontinuerliga koncentrationsgradienter av antibiotika. Bakterien vars resistens ska undersökas inokuleras jämnt över en agarplatta, oftast Mueller Hinton agar. Direkt efter inokulering läggs remsan med den antimikrobiella koncentrationsgradienten på den inokulerade agarplattan, vilken inkuberas under 18-24 tim. Efter det att E-testremsan har applicerats på den inokulerade agarplattan, sker en omedelbar frisättning av antibiotika. Efter inkubering syns en symmetrisk hämningsellips centrerad längs remsan. Skärningen av den nedre delen av det elipsformade tillväxtområdet med testremsan anger MIC-värdet, såvida inte bakterien är resistent mot den testade antimikrobiella substansen då växt sker längs hela remsan.
Uppdaterad: 2025-05-13.
InnehållDet finns också snabbmetoder för att undersöka om bakterierna är bärare av enzymer som bryter ned antibiotika. De enzym som rutinmässigt undersöks är förekomst av:
b-laktamas (penicillinas) vilket är ett enzym som hydrolyserar b-laktamringen i penicilliner som då inaktiveras. b-laktamasbildande stammar har inte alltid så höga MIC-värde att de vid andra resistensundersökningsmetoder skulle klassas som resistenta. Undersökning avseende b-laktamasproduktion görs därför parallellt med microdilution när stafylokocker undersöks. Flera olika metoder finns och nedan beskrivs två vanliga metoder.
Klöverbladsmetoden är ett enkelt och säkert sätt att påvisa b-laktamasproduktion. En agarplatta inokuleras jämnt med en bakteriestam som är känslig för penicillin (teststam). I centrum av plattan läggs en pappersdisk med penicillin (ofta 10 µg). Radiellt ut från pappersdisken stryks de stammar som ska analyseras för penicillinas produktion samt en positiv och en negativ kontrollstam. Efter ett dygns inkubering kontrolleras det att teststammen har hämmats kring penicillindisken. Längs med "stryket" av stammar som bildar b-laktamas kan teststammen "växa med" längre in mot penicillinlappen eftersom penicillinet runt dessa stammar har hydrolyserats och blivit inaktivt. Om enbart fyra positiva stammar testas på en platta kommer hämningszonen att se ut som en fyrklöver - därav metodens namn.
Snabbmetod med kromogena cefalosporiner: Cefalosporiner har en b-laktamring i sin struktur. Bland de olika cefalosporinet som utvecklas finns några där hydrolys av b-laktamringen medför en färgförändring av substansen, därav uttrycket kromogena.
Nitrocefin är en kromogen cefalosporin som finns kommersiellt tillgänglig intorkad på filterpapperslappar. Lappen läggs direkt på agarytan på ett ställe med god växt av det isolat som ska undersökas. Lappen suger upp fukt från mediet och om b-laktamas finns bildat i de kolonier man lagt lappen på kommer den inom 30 min att ändra färg från gul till röd.
Det är viktigt att testen inte görs på medier som innehåller blod eller serum då det i serum finns ämnen som förorsakar en falskt positiv reaktion. Om man bara har tillgång till en kultur på blodagar kan lappen läggas på t ex ett objektglas och fuktas med destillerat vatten varefter kolonimaterial överförs till lappen med en ögla. Det är dock av stor vikt att lappen inte torkar ut under de 30 min som reaktionen tar. I viss mån kan b-laktamasproduktion vara inducerbar, speciellt hos koagulasnegativa stafylokocker.
Uppdaterad: 2024-06-17.
InnehållÄven om fenotypiska metoder är de oftast använda metoderna för undersöknig av antimikrobiell resistens, så används även genotypiska (molekylära) metoder för identifiering av resistensgener. Metoderna är ofta baserade på konventionell PCR (Polymerase Chain Resction), real tids PCR eller helgenomsekvensering (WGS, whole genome sequencing). Dessa metoder påvisar en gen eller mutation i en gen som ger upphov till en viss resistensmekanism, den tar dock inte hänsyn till om genen uttrycks eller inte, bara om den finns eller inte.
Uppdaterad: 2024-06-17.
InnehållEfter provsättningen görs en kontroll att den undersökta bakterien är i renkultur genom att stryka testbuljongen på en oslektiv agarplatta. Brunnarna som fylls sist innehåller ingen antibiotika och används som positiv kontroll (Bild: Homayoon Davam & Ingrid Hansson, HBIO) - Klicka på bilden för att förstora den.
Oavsett vilken metod som används vid resistensbestämning är det viktigt att undersökningen sker enligt standardiserade metoder och att den är kvalitetssäkrad. Det är nödvändigt att bakterien som ska undersökas är i renkultur. Dessutom påverkas resultatet av bakterietäthet, temperatur och odlingsmiljö. De flesta bakterier testas under samma förhållanden, men vissa kräver andra tillväxtmedier och förhållanden (atmosfär, inkubationstid och temperatur). När tillståndet ändras kan det vara nödvändigt med ytterligare kvalitetskontroll för dessa förhållanden.
Vid microdilution i kommersiella microtiterplattor strävar man efter en bakteriekoncentration på 104-105 CFU/ml, vilken kontrolleras genom ytspridning av ympningsbuljongen på oselektiv agarplatta såsom blodagar. Vid mikrodilutionsmetoder är det viktigt att plattan förseglas så att ingen avdunstning sker vilket kan öka koncentrationen aktiv substans och falskt låga värden kan erhållas. MIC-värdet bedöms som den lägsta koncentrationen där det skett en total hämning av bakterieväxt. Detta kan vara svårt att avgöra framförallt vad gäller bakteriostatiska substanser där det ofta sker en gradvis minskning av växten
För diffusionsmetoder mäts hämningszonen vilken ibland kan vara svår att tolka då zongränsen kan vara svår att bedöma. En agar platta som inte är horisontell, gammal (uttorkad) eller för fuktig innebär att vissa bakterier svärmar kan innebära ett felaktigt resultat. Inkubering i anaerob eller mikroaerofil miljö förändrar pH i mediet och därmed diffusionsegenskaperna. Vidare är regressionslinjerna gjorda för bakterier med hög tillväxthastighet, tolkningen kan därför bli svårbedömd för långsam växande bakterier.
Uppdaterad: 2024-06-17.
Innehåll